Ejercicio Resuelto sobre Calorimetría
publicidad
Determine el calor necesario para transformar 100 g de hielo a −10 °C en 100 g de vapor a 100 °C. También realice un gráfico de la temperatura en función de la cantidad de calor de las transformaciones. Datos:
calor específico del hielo: ch = 0,5 cal/g°C;
calor latente de fusión: LF = 80 cal/g;
calor específico del agua: ca = 1,0 cal/g°C;
calor latente de vaporización: Lv = 540 cal/g.
Datos del problema:
- Masa de hielo: m = 100 g;
- Temperatura inicial del hielo: ti = −10 °C;
- Temperatura final del vapor: tf = 100 °C;
- Calor específico del hielo: ch = 0,5 cal/g°C;
- Calor latente de fusión: LF = 80 cal/g;
- Calor específico del agua: ca = 1,0 cal/g°C;
- Calor latente de vaporización: Lv = 540 cal/g.
- 1.ª Parte
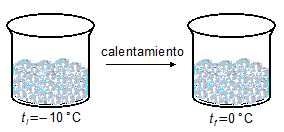
\[
\begin{gather}
\bbox[#99CCFF,10px]
{Q=mc\Delta t} \tag{I}
\end{gather}
\]
\[
\begin{gather}
Q_1=mc_h\Delta t \\[5pt]
Q_1=m c_h(t_0-t_{-10}) \\[5pt]
Q_1=100\times 0,5\times[0-(-10)] \\[5pt]
Q_1=100\times 0,5\times 10 \\[5pt]
Q_1=500\;\mathrm{cal}
\end{gather}
\]
- 2.ª Parte
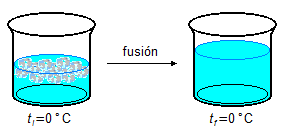
\[
\begin{gather}
\bbox[#99CCFF,10px]
{Q=mL} \tag{I}
\end{gather}
\]
\[
\begin{gather}
Q_2=mL_F \\[5pt]
Q_2=100\times 80 \\[5pt]
Q_2=8000\;\mathrm{cal}
\end{gather}
\]
- 3.ª Parte
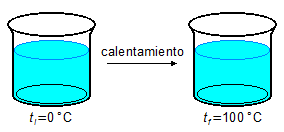
\[
\begin{gather}
Q_3=m c_a\Delta t \\[5pt]
Q_3=m c_a(t_{100}-t_0) \\[5pt]
Q_3=100\times 1,0\times(100-0) \\[5pt]
Q_3=100\times 1,0\times 100 \\[5pt]
Q_3=10000\;\mathrm{cal}
\end{gather}
\]
- 4.ª Parte
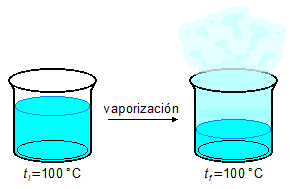
\[
\begin{gather}
Q_4=mL_v \\[5pt]
Q_4=100\times 540 \\[5pt]
Q_4=54000\;\mathrm{cal}
\end{gather}
\]
El calor total necesario para transformar 100 g de hielo a −10°C en vapor a 100°C será la suma de
todas las partes calculadas anteriormente
\[
\begin{gather}
Q=Q_1+Q_2+Q_3+Q_4 \\[5pt]
Q=500+8000+10000+54000
\end{gather}
\]
\[
\begin{gather}
\bbox[#FFCCCC,10px]
{Q=72500\;\mathrm{cal}}
\end{gather}
\]
Colocando en un gráfico los valores de las temperaturas de cada fase de las transformaciones y las cantidades
de calor acumuladas en cada fase, obtenemos el gráfico de la Figura 5 a continuación
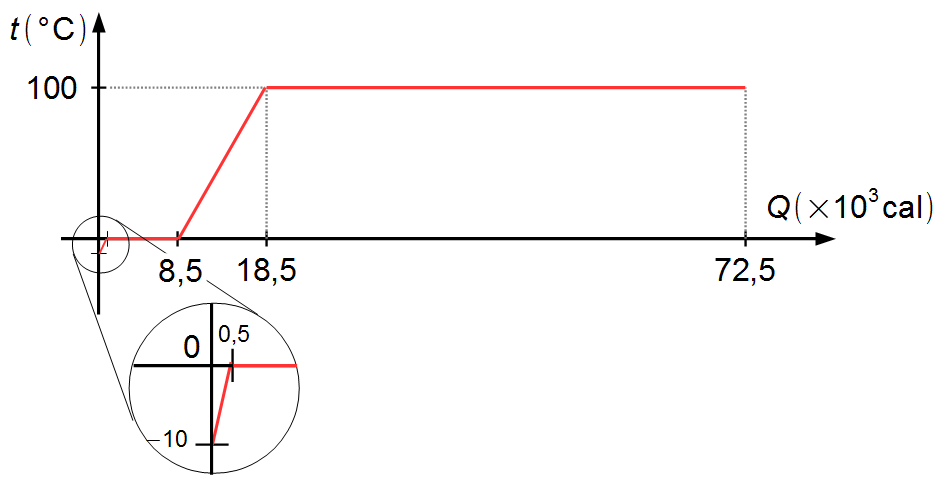
Observación: nótese que, realizado el gráfico a escala, la cantidad de calor necesaria para
calentar el hielo de −10 °C a 0 °C está representada por una parte muy pequeña (mostrada en detalle),
mientras que la cantidad de calor necesaria para vaporizar el agua a 100 °C ocupa la mayor parte del
gráfico.
publicidad

Fisicaexe - Physics Solved Problems by Elcio Brandani Mondadori is licensed under a Creative Commons Attribution-NonCommercial-ShareAlike 4.0 International License .