Exercício Resolvido de Termodinâmica
publicidade
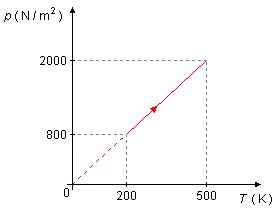
Um gás sofre uma transformação, mostrada no gráfico p=f(T). Sendo a
Constante universal dos gases perfeitos R=8,31 J/mol.K, o número de mols do gás n=5,
o calor molar do gás a volume constante CV=5 cal/mol.K e 1 cal=4,18 J. Determine:
a) A transformação sofrida pelo gás;
b) O volume do gás durante o processo;
c) A quantidade de calor que o gás recebe durante a transformação;
d) A variação da energia interna do gás nessa transformação.
a) A transformação sofrida pelo gás;
b) O volume do gás durante o processo;
c) A quantidade de calor que o gás recebe durante a transformação;
d) A variação da energia interna do gás nessa transformação.
Dados do problema:
- Número de mols do gás: n = 5 mol;
- Calor molar do gás a volume constante: CV = 5 cal/mol.K;
- Constante universal dos gases perfeitos: R = 8,31 J/mol.K;
- Equivalente mecânico do calor: 1 cal = 4,18 J.
a) Usando a Lei dos Gases durante uma transformação \( \dfrac{pV}{T}=k \), onde k é constante, escrevendo \( p=\dfrac{k}{V}T \), vemos no gráfico que a transformação é linear, então \( \dfrac{k}{V} \) é constante, portanto V também é constante e a transformação é isométrica (ou isovolumétrica, ou isocórica).
Observação: A expressão
\( p=\frac{k}{V}T \)
que caracteriza a transformação isométrica é uma função de 1.° Grau do tipo
\( y=ax+b \),
onde podemos fazer as seguintes associações
\[
\begin{array}{c}
y & = & a & x & + & b \\
{\color{red}\downarrow} & & {\color{red}\downarrow} & {\color{red}\downarrow} & & {\color{red}\downarrow} \\
p & = & \dfrac{k}{V} & T & + & 0
\end{array}
\]
b) A partir do gráfico obtemos o par de valores T = 500 K e p = 2000 N/m2, utilizando a Equação de Clapeyron
\[ \bbox[#99CCFF,10px]
{pV=nRT}
\]
e os dados do problema
\[
\begin{gather}
2000V=5.8,31.500\\
V=\frac{20775}{2000}
\end{gather}
\]
\[ \bbox[#FFCCCC,10px]
{V=10,4\;\text{m}^{3}}
\]
c) A quantidade de calor recebida pelo gás é dada por
\[ \bbox[#99CCFF,10px]
{Q=nC_{V}\Delta T}
\]
A temperatura inicial do gás é de T1 = 200 K e a temperatura final de
T2 = 500 K, portanto a variação da temperatura será de
\( \Delta T=T_{2}-T_{1}=500-200=300\;\text{K} \)
\( \Delta T=T_{2}-T_{1}=500-200=300\;\text{K} \)
e utilizando os outros dados do problema
\[
\begin{gather}
Q=5.5.300\\
Q=7500\;\text{cal}
\end{gather}
\]
convertendo este valor para Joules
\[
Q=7500\;\cancel{\text{cal}}.\frac{4,18\;\text{J}}{1\;\cancel{\text{cal}}}
\]
\[ \bbox[#FFCCCC,10px]
{Q=31350\;\text{J}}
\]
d) Usando Primeira Lei da Termodinâmica
\[ \bbox[#99CCFF,10px]
{\Delta U=Q-W}
\]
o trabalho W é dado por
\[ \bbox[#99CCFF,10px]
{W=p\Delta V}
\]
mas a transformação é isométrica, assim ΔV é igual a zero, e temos que
ΔU = Q
\[ \bbox[#FFCCCC,10px]
{\Delta U=31350\;\text{J}}
\]
publicidade

Fisicaexe - Exercícios Resolvidos de Física de Elcio Brandani Mondadori está licenciado com uma Licença Creative Commons - Atribuição-NãoComercial-Compartilha Igual 4.0 Internacional .