Exercício Resolvido de Termodinâmica
publicidade
Um mol de um gás ideal sofre uma transformação isobárica, sob pressão p, passando do volume V ao volume 2V. Calcule a quantidade de calor absorvida pelo gás.
Dados do problema:
| Estado inicial | Estado final |
|---|---|
| Pressão: p1 = p | Pressão: p2 = p |
| Volume: V1 = V | Volume: V2 = 2V |
| Número de mols: n1 = 1 mol | Número de mols: n2 = 1 mol |
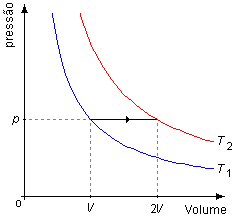
Esquema do problema:
A transformação está representada no Gráfico 1 pela linha em preto entre as isotermas
T1 e T2, onde o gás é levado de um volume inicial V para um
volume final 2V à pressão constante p.
Solução
A quantidade de calor absorvida pelo gás pode é calculada usando a equação
\[
\begin{gather}
\bbox[#99CCFF,10px]
{Q=nC_{p}\Delta T} \tag{I}
\end{gather}
\]
Para calcular a variação da temperatura usamos a Equação de Clareyron
\[ \bbox[#99CCFF,10px]
{pV=nRT}
\]
Podemos escrever a temperatura para os estados inicial e final, respectivamente
\[
\begin{gather}
T_{1}=\frac{p_{1}V_{1}}{n_{1}R} \tag{II-a}
\end{gather}
\]
\[
\begin{gather}
T_{2}=\frac{p_{2}V_{2}}{n_{2}R} \tag{II-b}
\end{gather}
\]
como
\( \Delta T=T_{2}-T_{1} \),
substituindo as expressões (II-a) e (II-b) na equação (I)
\[
\begin{gather}
Q=nC_{p}(T_{2}-T_{1})\\
Q=nC_{p}\left(\,\frac{p_{2}V_{2}}{n_{2}R}-\frac{p_{1}V_{1}}{n_{1}R}\,\right)
\end{gather}
\]
substituindo os valores dados
\[
\begin{gather}
Q=1.C_{p}\left(\,\frac{p2V}{1.R}-\frac{pV}{1.R}\,\right)\\
Q=C_{p}\left(\,\frac{pV}{R}\,\right)
\end{gather}
\]
mas
\( \bbox[#99CCFF,10px] {C_{p}=C_{V}+R} \)
\[
\begin{gather}
Q=(C_{V}+R).\left(\,\frac{pV}{R}\,\right)\\
Q=pV.\left(\,\frac{C_{V}+R}{R}\,\right)
\end{gather}
\]
\[ \bbox[#FFCCCC,10px]
{Q=pV.\left(\,\frac{C_{V}}{R}+1\,\right)}
\]
publicidade

Fisicaexe - Exercícios Resolvidos de Física de Elcio Brandani Mondadori está licenciado com uma Licença Creative Commons - Atribuição-NãoComercial-Compartilha Igual 4.0 Internacional .